Composition Structure
Les briques élémentaires des protéines sont les acides aminés (comme les nucléotides sont les briques élémentaires des acides nucléiques). Les acides aminés sont au nombre de 20, la formule générale d'un acide aminé est :
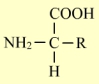
Le même carbone porte à la fois une fonction carboxyle (-COOH) et une fonction amine
(-NH2).
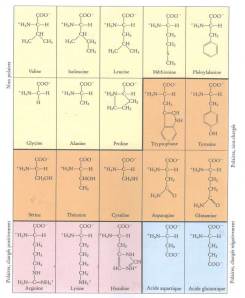
Le tableau ci-dessous représente la formule et les propriétés des acides aminés qui varient en fonction du radical R
 Informations[1]
Informations[1]Comme c'est illustré sur le tableau par l'usage de couleurs différentes, la nature du radical R va apporter des propriétés chimiques différentes à l'acide aminé correspondant. Par exemple , il existe des acides aminés hydrophobes, des acides aminés chargés (positifs ou négatifs, hydrophiles). Certains acides aminés peuvent ainsi être regroupés par rapport à leurs propriétés chimiques
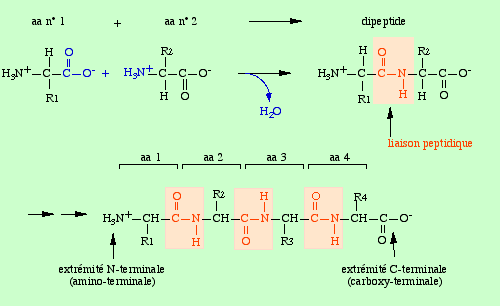
Les acides aminés sont les briques élémentaires des protéines, ils peuvent se lier entre eux par une liaison peptidique.
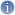 Informations[2]
Informations[2]On obtient un enchaînement d'acides aminés dont l'extrémité N-terminale correspond à la fonction –NH2 du premier acide aminé et l'extrémité C-terminale à la fonction –COOH du dernier acide aminé.
La structure primaire d'une protéine peut être représentée comme un collier de perles où chaque perle est un acide aminé.
 Informations[3]
Informations[3]Intéractions entre acides aminés
On peut noter sur ce schéma des interactions entre des acides aminés éloignés les uns des autres, par l'intermédiaire de leur radical R, ces interactions font intervenir :
L'effet hydrophobe
Les acides aminés dont les radicaux sont hydrophobes ont plus d'affinité entre eux qu'avec les molécules d'eau entourant la protéine. La chaîne a donc tendance à se replier de façon à les regrouper entre eux au centre de la molécule, sans contact direct avec l'eau. Inversement, les acides aminés hydrophiles ont tendance à se disposer à la périphérie de façon à être en contact avec l'eau.
Les liaisons ioniques
Les radicaux qui s'ionisent positivement forment des liaisons ioniques avec ceux qui s'ionisent négativement.
Les liaisons hydrogène
Elle est de basse intensité (vingt fois plus faible que liaison covalente classique), et relie des molécules en impliquant un atome d'hydrogène
Les ponts disulfure
Deux des 20 acides aminés ont des radicaux contenant un atome de soufre. C'est le cas de la cystéine. Deux cystéines peuvent former une liaison covalente entre elles par l'intermédiaire de l'atome de soufre de leur radical.
Cette liaison covalente peut relier deux cystéines éloignées l'une de l'autre sur la chaîne.
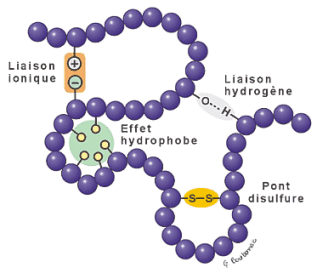
Structure secondaire des protéines
Ces différentes interactions aboutissent à la structure secondaire des protéines qui correspond à la structuration dans l'espace de zones en hélice α formée par l'enroulement régulier d'une chaîne polypeptidique sur elle-même et de feuillets β. Les feuillets bêta ou feuillets bêta plissé sont des structures secondaires qui s'observent dans des portions de protéines. Ils se matérialisent sous forme d'un pli successif avec différentes ondulations de la chaîne polypeptidique (comme un accordéon).
La structure tertiaire d'une protéine correspond au repliement de la chaîne polypeptidique dans l'espace. On parle plus couramment de structure tridimensionnelle. La structure tridimensionnelle d'une protéine est intimement liée à sa fonction: lorsque cette structure est cassée par l'emploi d'agent dénaturant, la protéine perd sa fonction: elle est dénaturée.
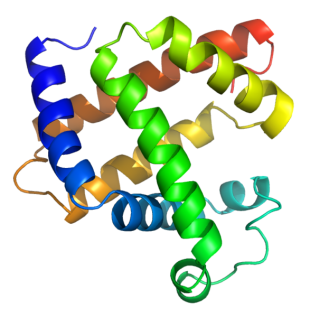
 Informations[4]
Informations[4]La structure quaternaire des protéines regroupe l'association d'au moins deux chaînes polypeptidiques - identiques ou différentes - par des liaisons non covalentes, liaisons dîtes faibles (liaison H, liaison ionique, interactions hydrophobes et force de Van der Waals), mais rarement par des ponts disulfures, qui ont pour rôle de créer les liaisons inter chaîne. L'effet hydrophobe est un facteur prépondérant dans l'assemblage des éléments structuraux, y compris dans l'association des sous-unités.
Chacune de ces chaînes est appelée monomère (ou sous-unité) et l'ensemble oligomère ou protéine multimérique.
L'hémoglobine est un exemple de structure quaternaire ; elle est constituée de 4 sous-unités : 2 sous-unités α (de 141 acides aminés) et 2 sous-unités β (de 146 acides aminés).
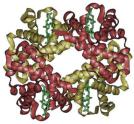
Chez l'être humain, l'hémoglobine adulte (HbA) est un tétramère, constitué de deux globines α et deux globines β liées par des liaisons faibles. Chez le nouveau-né, il s'agit d'hémoglobine fœtale avec deux globines α et deux globines γ.





