La méthode du nombre plus probable (NPP)
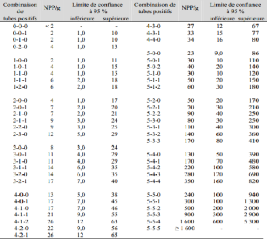
La méthode du nombre plus probable (NPP) est une technique statistique efficace d'estimation des densités de populations microbiennes, surtout lorsqu'une évaluation quantitative des cellules individuelles n'est pas possible. La technique est basée sur la détermination de la présence ou l'absence (pos ou nég) des micro-organismes dans les échantillons de sol ou d'autres environnements, sur des essais de dilutions de plus en plus fortes, en fonction d'attributs spécifiques. Par conséquent, une condition importante pour cette méthode est qu'il fallait reconnaître un attribut particulier de la population étudiée dans le milieu de culture. La densité de population est estimée sur le modèle de la présence de cet attribut ou non à des dilutions successives et l'utilisation d'un tableau probabiliste .
Matériaux & équipements
• Échantillons environnementaux (boues activées, rivières, étangs, sol, etc.).
• Boîtes de Pétri avec les milieux de culture (R2A, LB, TSA ou autres selon le type de bactérie étudiée)
• Tubes pour la dilution avec 9 ml de solution saline (0,85 % NaCl)
• Micropipettes du 20 μl
• Incubateur à 25° C
• Vortex
Méthodologie
1. Échantillons : Recueillir aseptiquement des échantillons frais de sol (10 g) de divers endroits.
2. Extraction de micro-organismes viables des échantillons de sol : les cellules peuvent êtres prélevées et homogénéisées en plaçant 1 g d'échantillon dans un tube à essai contenant 9 ml de solution saline. Remuer pendant 5 minutes dans un tourbillon.
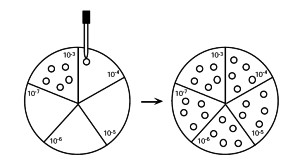
3. Des dilutions successives : l'extrait de sol peut être diluée par série, transférer 1 ml dans un tube contenant 9 ml de 0,85 % NaCl. Chaque transfert correspond à une dilution de 1 à 10. Répétez la procédure de dilution en série jusqu'à la dilution à 10-7
 | 4. Pétri : diviser le Pétri en cinq zones de taille égale. Utiliser une part pour chaque échantillon. Chaque zone doit être noté avec le facteur de dilution qui lui correspond |
5.Inoculation : Transférer 5 μl sur la zone correspondant à la dilution. Répétez cette opérationà cinq reprises pour chaque dilutions. |
6. Mettre l'inoculum à sécher sur le milieu de croissance. Ajouter une plaque de paraffine pour l'étanchéité . Inverser et incuber à 25° C pendant 7 jours.
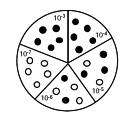 | 7. Évaluation de la croissance : pour chaque dilution, évaluer le développement ou non sur chaque réplique de dilution ensemmencée. Rapporter les résultats comme illustré dans l'exemple ci-dessous : dilution 103 – 104 – 105 – 106 – 107 : 5 - 5 - 3 - 2 – 0 |
Analyse des données
En utilisant les valeurs indiquées dans le tableau du nombre plus probable pour les dilutions en répliques de cinq niveaux de dilution, déterminer la population estimée pour votre échantillon (ex., 5-5-3-2-0: 1,383). Si la répartition des réponses n'est pas sur la table, valeur estimée moyenne de modèle haut et en bas dans la table. Cette valeur correspond au nombre plus probable sans réglage (NPPR). Pour calculer la densité de population de l'échantillon, puis vous devez multiplier la NPPR par le facteur de correction de volume par la réciproque de la plaque de facteur inoculé de dilution plus faible (ex., 5-5-3-2-0: 1,383 X 200 X 1000 = 2.78 x 108 cellules/g de sol).